Actuellement le méthanol, puisqu’il n’est pas présent en quantité importante dans la nature, est donc produit industriellement. Il est fait à partir de H2 (dihydrogène) et de CO (monoxyde de carbone) un gaz qui peut être mortel pour l’homme et qui n’est pas non plus présent dans la nature.
La production de méthanol à partir d’acide formique serait donc une bonne alternative.
En effet des chercheurs du Commissariat à l’énergie atomique et aux énergies alternatives (CEA) ont réussi à produire du méthanol grâce à une technique bien plus efficace que celle qui était utilisée aujourd’hui.
Sachant qu’à ce jour, la demande énergétique de la planète est satisfaite à 85 % par les énergies fossiles, il est temps de trouver des alternatives avec des énergies renouvelables.
En effet, les réserves de pétrole et de gaz naturel sont en passe de s’épuiser. Ce sont les travaux du chimiste Paul Sabatier en 1911 qui explique pour la première fois que l’acide formique est un bon moyen de synthétiser du méthanol. Puis c’est en 2013 que l’intérêt pour cette étude est revenue, grâce à des chercheurs de l’université de Washington.
Ils ont découvert que l’iridium était un bon catalyseur (substance qui sert à augmenter la vitesse d’une réaction chimique) facilitant la transformation des molécules d’acide formique en méthanol. Mais ce catalyseur a vite été écarté de par son coût trop élevé (c’est une substance chimique très rare), ainsi que par son rendement trop faible (seulement 2%).
Pour remplacer cette substance, les scientifiques (du CEA) ont découvert un autre catalyseur bien plus efficace: le ruthénium, en effet il a un rendement de 50% et coûte 10 fois moins chère que l’iridium. Le complexe hydrure de ruthénium permet de redistribuer la liaison CH de l’acide formique pour former du méthanol et deux molécules de CO2 à partir de trois molécules d’acide formique.
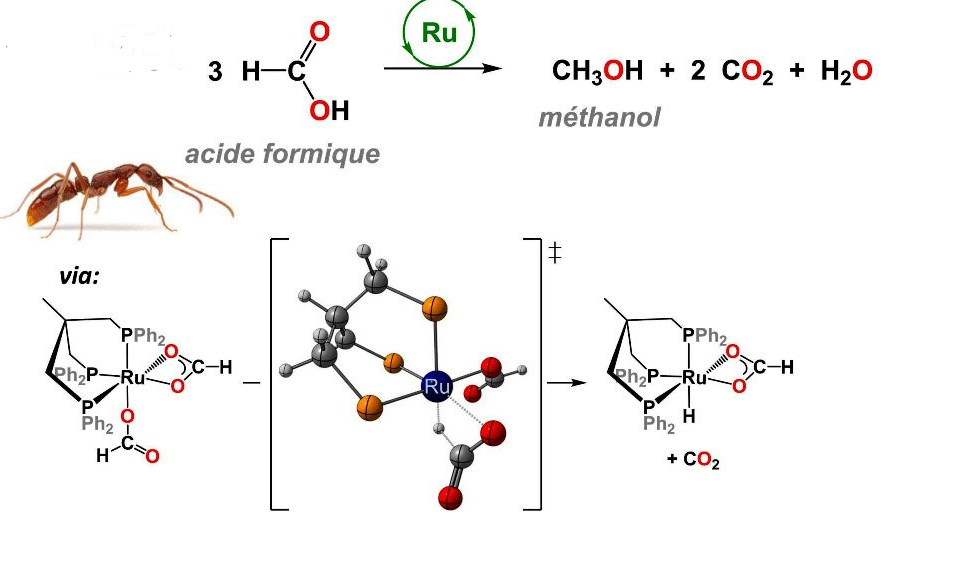
Cette réaction permet donc de former du méthanol et deux molécules de CO2 à partir de trois molécules d’acide formique à l’aide d’un complexe de ruthénium.

